- + Merck Millipore
- + Thermo Fisher
- + IKA
- + 顯微鏡
- + 光度計
- + 成像系統
- + MACS Miltenyi
- + 均質機
- + 粒子計數器
- + 凍干機
- + 滅菌系統
- + 細胞
- + 微量移液工作站
- + 振蕩培養箱
- + 生物反應器
- + 切片機
- + 培養箱
- + 蠕動泵
- + 細胞破(粉)碎機
- + 轉印膜
- + 超濾管
- + Pellicon 超濾系統
- + 超低溫冰箱
- + 清洗機
- + 干燥機
- + 洗瓶機
- + 離心泵
- + 容積泵
- + 各種閥
- + 酶標儀
- + 洗衣板
- + 旋光儀
- + 折光儀
- + 行星球磨機
- + 振動篩
- + 基因導入儀
- + 手套系列
- + 接頭\\連接器
- + 培養板/培養瓶
- + 溫度控制系統
- + 制冷器
- + 存取系統
- + 軋蓋機
- + 細胞因子
- + 細胞分選儀
- + 生物安全柜
- + 滲透壓儀
- + 拉曼光譜儀
- + 電泳系統
- + 純水系統
- + 萃取儀
- + 譜新生物
- + TA 儀器
- + wako
還在為如何提取完整的外泌體發愁嗎?
更新時間:2022-04-14 瀏覽次數:2469
在過去的幾十年中,外泌體因其在改變細胞功能中的作用而受到了廣泛關注。外泌體是膜結合的納米級囊泡,最初通過晚期核內體的內陷形成為特定的腔內囊泡群。由于晚期多泡內體與質膜融合,這些內體來源的腔內囊泡隨后被釋放到細胞外環境中,這是一種將它們與其他類型的細胞外囊泡區分開來的生物發生機制[1]。
因此,外泌體外膜由富含供體細胞膜衍生蛋白的磷脂雙層和繼承細胞質生物分子(包括蛋白質、酶、mRNA、miRNA 和代謝物)的水內核組成。外泌體的大小在 20-120 nm 之間,并且在形態和結構上因親代細胞而異[2]。外泌體亞群呈現出不同的形狀,從球形到絲狀和細長形,還可以包括不同的子隔室[3]。

外泌體結構及形成過程
目前,已經開發了多種分離策略來從各種生物來源中離外泌體,這些生物來源包括牛奶、血液和尿液,以及植物衍生產品,例如水果和蔬菜。
外泌體利用多種內吞機制進入細胞。有趣的是,外泌體還可以克服物種障礙,在不同來源的細胞之間傳遞生物分子[4]。外泌體介導生物功能,從而調節體內重要的生理和病理過程[5]
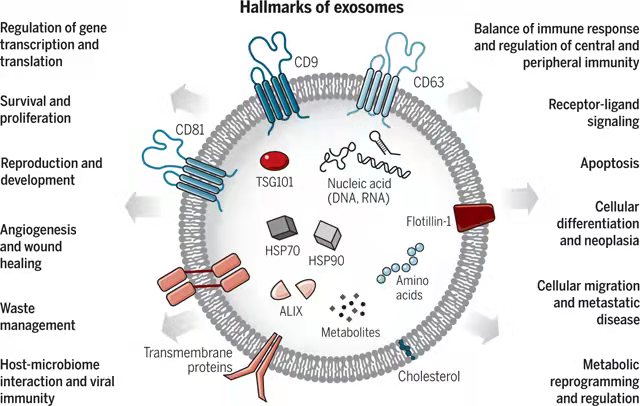
外泌體生物學功能
由于外泌體是內源性具有生物活性的生物分子的天然載體,它們已被廣泛用于主動和被動傳遞合成生物分子。它們的內源性和納米特性也使這些納米載體能夠跨越生物屏障,并賦予它們優良的生物相容性[6]。
因此,這幾年各領域廣泛展開外泌體相關的研究,外泌體研究橫跨幾乎所有的研究領域(免疫、神經系統、腫瘤、內分泌、循環系統等)。
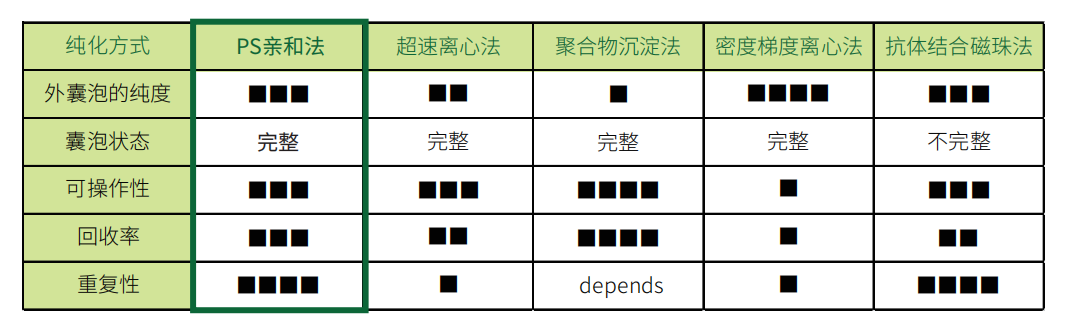
然而,目前用于外泌體研究的實驗技術仍處于開發階段,許多問題仍有待改進。例如,外泌體純化方法中,超速離心法和聚合物沉淀法(市售試劑盒)提取的外泌體中混有多種雜質,會給后續實驗造成許多障礙。而抗體親和法和密度梯度離心法這兩種提取方法的問題在于,雖然可以提取到高純度的外泌體,但外泌體結構不完整,無法用于分析外泌體的生理功能。
磷脂酰絲氨酸和Tim4新型外泌體提取法
外泌體膜雖然含有分泌細胞源蛋白質和脂質,但目前普遍認為在活細胞中磷脂酰絲氨酸(PS)通過脂質翻轉酶作用定位于細胞膜內側[7]。
作為通過巨噬細胞進行細胞凋亡的吞噬受體(T-cell immunoglobulin domain and mucin domain-containing protein 4,Tim4)蛋白通過細胞外域IgV域與結合了鈣離子的PS結合[8]。
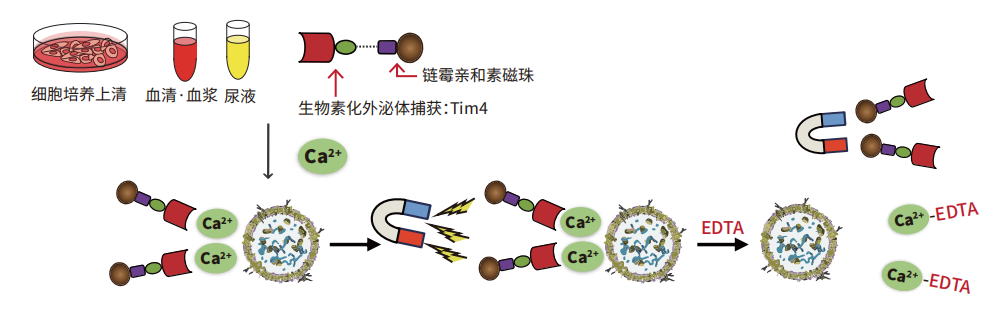
利用這一原理,Wako和金澤大學醫學系免疫學華山教授共同開發一款劃時代的外泌體提取方法,利用Tim4固化磁珠,在鈣離子存在下捕捉培養上清和血清等樣品中的外泌體,再添加螯合劑從而提取外泌體[9]。并且MagCapture™外泌體提取試劑盒PS實現了比傳統的外泌體純化法更加簡單地提取高純度完整狀態的外泌體。
這是迄今為止取代黃金標準超速離心法的新型外泌體純化法。
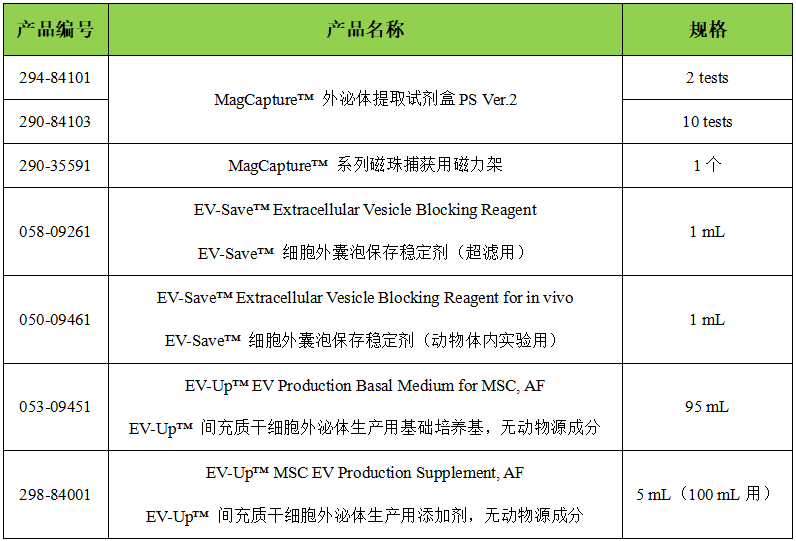
MagCapture™ 外泌體提取試劑盒PS
巨噬細胞表面的Tim4蛋白特異性結合細胞外囊泡表面的磷酯酰絲氨酸(PS)。
利用Tim4固化磁珠,在Ca2+ 存在條件下捕捉培養上清或血清等樣本中的外泌體,通過使用含有EDTA的洗脫液洗脫,可獲得高純度的完整細胞外囊泡(EVs)。
01
原理
02
特點
● 可獲得高純度完整細胞外囊泡,可用于蛋白及核酸分析、共培養及體內注射
● 回收率高
● 操作簡便(3.5h),不需超速離心
03
應用實例
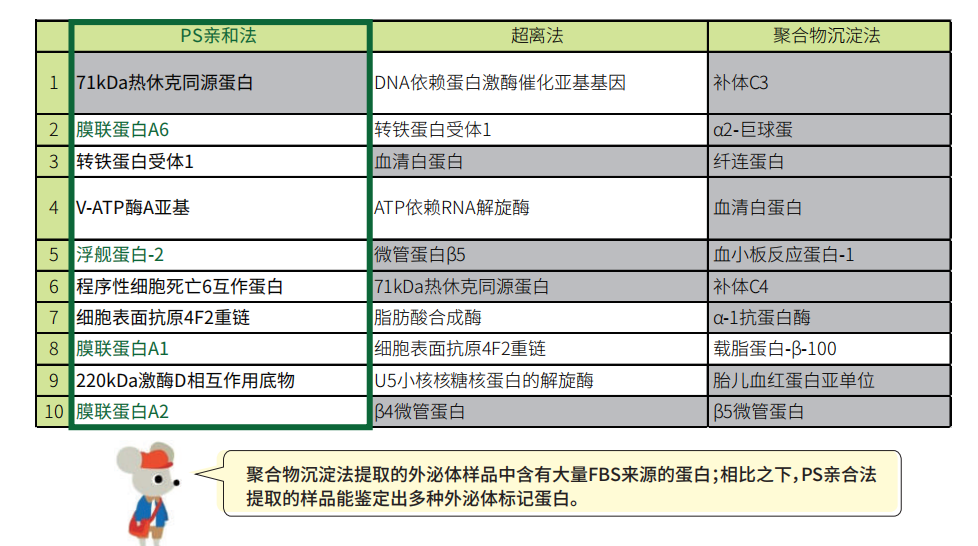
外泌體蛋白質組學分析
通過MASS鑒定結果比較豐度最高的前 shi 種蛋白。
樣品:K562細胞培養上清(含10%去外泌體FBS)
白色柱:源自外囊泡的人類蛋白
灰色柱:來自FBS的牛蛋白污染物
綠色:來自外囊泡的標記蛋白
[9] Nakai Wataru.et al. (2016). A novel affinity-based method for the isolation of highly purified extracellular vesicles. Sci Rep, 6, 33935.
- (上一篇):能否用好CO2培養箱,在于您對其特點了解多少!
- (下一篇):如何正如何正確的選擇搖床振幅?